NatriumFlammenfaerbung
Natrium hat eine charakteristische kraeftig orange Flammenfaerbung. Ist in der Ursubstanz Natrium enthalten, so ist dies in der Flamme eindeutig zu erkennen.
Ein Magnesiastaebchen (die Spitze nicht mit den fingern beruehren!) wird auf der entleuchteten Bunsenbrennerflamme ausgeglueht, die Spitze anschiessend in die Ursubstanz getunkt und wieder in die Brennerflamme gehalten. Eine charakteristisch orange Flamme zeigt Natrium an.
Achtung: Die kraeftige Natriumfarbe kann andere Flammenverbungen verschlucken. Die anderen Alkalimetalle sind dann trotz ihrer Anwesenheit oft nicht mehr zu erkennen.
Natriumhexahydroxyantimonat
Die konzentrierte Probe (der Nachweis funktioniert nur in konzentrierter Loesung) wird mit Kalilauge schwach alkalisch konditioniert. Anschliessend wird Kaliumhexahydroxyantimonat hinzugegeben und kurz erhitzt. Ein weisser Feststoff zeigt 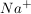 an. an.
Der Nachweis funktioniert nur in konzentrierter Loesung und wird unter anderem von Ammonium gestoert.
zurück zu
Analytische Chemie
|