pH-Wert
Das Ionenprodukt des Wassers
Das Wasser geht eine reversible Reaktion mit sich selbt ein, wobei Hydroxid-  und Oxoniumionen und Oxoniumionen  entstehen. entstehen.
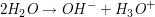
Die Gleichgewichtskonstante 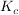 berechntet sich laut dem Massenwirkungsgesetz durch berechntet sich laut dem Massenwirkungsgesetz durch
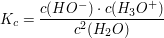
Das Gleichgewicht liegt sehr stark auf Seiten der 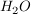 -Moleküle. Die Konzentration des Wassers kann demnach als konstant angenommen werden. -Moleküle. Die Konzentration des Wassers kann demnach als konstant angenommen werden.
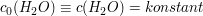
Die Konzentration des Wassers kann somit in die Gleichgewichtskonstante hineingezogen werden, es entsteht eine neue Konstante.
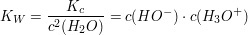
Die neue Konstante  wird als Ionenprodukt des Wassers bezeichnet. wird als Ionenprodukt des Wassers bezeichnet.
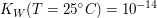
Der pKw-Wert
Der 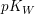 -Wert entspricht dem negativen dekadischen Logarithmus des -Wert entspricht dem negativen dekadischen Logarithmus des  -Wertes. -Wertes.
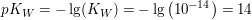
Wie aus der nachfolgenden Erklärung ersichtlich, gilt unabhängig von der Temperatur
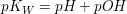
Der pH-Wert
Der pH-Wert entspricht dem negativen dekadischen Logarithmus der Konzentration der Oxoniumionen.
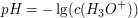
In einer neutralen Lösung ist die Konzentration der Oxoniumionen gleich der Konzentration der Hydroxidionen. Bei 25°C folgt daraus
Bei 25°C werden Lösungen, deren Konzentration an Oxoniumionen größer als 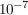 ist, als sauer bezeichnet. Lösungen, deren pH-Wert größer als 7 ist, sind alkalisch (auch basisch). ist, als sauer bezeichnet. Lösungen, deren pH-Wert größer als 7 ist, sind alkalisch (auch basisch).
Der pOH-Wert
Der pOH-Wert entspricht dem negativen dekadischen Logarithmus der Konzentration der Hydroxidionen.
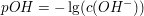
Zurück
MatheBank - PhysikBank - ChemieBank - AllgemeineChemie
|